Hukum-hukum termodinamika pada prinsipnya menjelaskan peristiwa perpindahan panas dan kerja pada proses termodinamika. Sejak perumusannya, hukum-hukum ini telah menjadi salah satu hukum terpenting dalam fisika dan berbagai cabang ilmu lainnya yang berhubungan dengan termodinamika. Hukum-hukum ini sering dikaitkan dengan konsep-konsep yang jauh melampau hal-hal yang dinyatakan dalam kata-kata rumusannya.
tidak dapat diciptakan dan dimusnahkan tetapi dapat dikonversi dari suatu bentuk ke bentuk yang lain." Hukum pertama adalah prinsip kekekalan energi yang memasukan kalor sebagai model perpindahan energi. Menurut hukum pertama, energi dalam suatu benda dapat ditingkatkan dengan menambahkan kalor ke benda atau dengan melakukan usaha pada benda. Hukum pertama tidak membatasi tentang arah perpindahan kalor yang dapat terjadi.
.KALOR JENIS DAN KAPASITAS KALOR JENIS
Kapasitas kalor (C) : jumlah kalor yang diperlukan untuk menaikkan temperatur dari suatu sampel bahan sebesar 1 Co.
DQ = C DT
Kapasitas panas dari beberapa benda sebanding dengan massanya, maka lebih mudah bila didefinisikan kalor jenis, c :
Kalor jenis, c : jumlah kalor yang diperlukan untuk menaikkan temperatur dari 1 gr massa bahan sebesar 1 Co.
DQ = m c DT
T2
Bila harga c tidak konstan : Q = ò m c dT
T1
Catatan : untuk gas kalor jenis biasanya dinyatakan untuk satu mol bahan, dsb kalor jenis molar,
DQ = n c DT
Kalor jenis beberapa bahan pada 25 C.
| Bahan | c (kal/gr. Co) | Bahan | c (kal/gr. Co) |
| Aluminium | 0,215 | Kuningan | 0,092 |
| Tembaga | 0,0924 | Kayu | 0,41 |
| Emas | 0,0308 | Glas | 0,200 |
| Besi | 0,107 | Es (-5 C) | 0,50 |
| Timbal | 0,0305 | Alkohol | 0,58 |
| Perak | 0,056 | Air Raksa | 0,033 |
| Silikon | 0,056 | Air (15 C) | 1,00 |
3. KALOR LATEN
Suatu bahan biasanya mengalami perubahan temperatur bila terjadi perpindahan kalor antara bahan dengan lingkungannya. Pada suatu situasi tertentu, aliran kalor ini tidak merubah temperaturnya. Hal ini terjadi bila bahan mengalami perubahan fasa. Misalnya padat menjadi cair (mencair), cair menjadi uap (mendidih) dan perubahan struktur kristal (zat padat). Energi yang diperlukan disebut kalor transformasi.
Kalor yang diperlukan untuk merubah fasa dari bahan bermassa m adalah
Q = m L
dimana L adalah kalor laten.
4. PERPINDAHAN KALOR
Bila dua benda atau lebih terjadi kontak termal maka akan terjadi aliran kalor dari benda yang bertemperatur lebih tinggi ke benda yang bertemperatur lebih rendah, hingga tercapainya kesetimbangan termal.
Proses perpindahan panas ini berlangsung dalam 3 mekanisme, yaitu : konduksi, konveksi dan radiasi.
.HUKUM II TERMODINAMIKA
idak mungkin membuat suatu mesin yang bekerja secara terus-menerus serta rnengubah semua kalor yang diserap menjadi usaha mekanis.
 | T1 > T2, maka usaha mekanis: W = Q1 - Q2 h = W/Q1 = 1 - Q2/Q1 = 1 - T2/T1 |
T1 = reservoir suhu tinggi
T2 = reservoir suhu rendah
Q1 = kalor yang masuk
Q2 =kalor yang dilepas
W = usaha yang dilakukan
h = efesiensi mesin
| Untuk mesin pendingin:
h = W/Q2 = Q1/Q2 -1 = T1/T2 - 1 Koefisien Kinerja = 1/h |
.SIKLUS TERMODINAMIKA
Siklus termodinamika adalah serangkaian proses termodinamika mentransfer panas dan kerja dalam berbagai keadaan tekanan, temperatur, dan keadaan lainnya. Hukum pertama termodinamika menyebutkan bahwa sejumlah bersih panas yang masuk setara dengan sejumlah bersih panas yang keluar pada seluruh bagian siklus. Proses alami yang berulang-ulang menjadikan proses berlanjut, membuat siklus ini sebagai konsep penting dalam termodinamika.
Proses termodinamika berlangsung dalam rantai tertutup pada diagram P-V, di mana axis Y menunjukkan tekanan (pressure, P) dan axis X menunjukkan volume (V).
Area di dalam siklus adalah kerja (work, W) yang dirumuskan dengan:
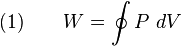
Kerja adalah setara dengan panas yang ditransferkan ke sistem:
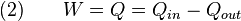
Persamaan kedua membuat proses siklik mirp proses isotermal, meski energi dalam berubah selama proses siklik, ketika proses siklik selesai energi sistem adalah sama dengan energi ketika proses dimulai. Jika proses siklik bekerja searah jarum jam, maka ini menunjukkan mesin kalor, dan W akan positif. Jika bergerak berlawanan dengan arah jarum jam, maka menunjukkan pompa kalor, dan W akan negatif.
.SISTEM DAN LINGKUNGAN
Termodinamika (bahasa Yunani: thermos = 'panas' and dynamic = 'perubahan') adalah fisika energi , panas, kerja, entropi dan kespontanan proses. Termodinamika berhubungan dekat dengan mekanika statistik di mana banyak hubungan termodinamika berasal.
Pada sistem di mana terjadi proses perubahan wujud atau pertukaran energi, termodinamika klasik tidak berhubungan dengan kinetika reaksi (kecepatan suatu proses reaksi berlangsung). Karena alasan ini, penggunaan istilah "termodinamika" biasanya merujuk pada termodinamika setimbang. Dengan hubungan ini, konsep utama dalam termodinamika adalah proses kuasistatik, yang diidealkan, proses "super pelan". Proses termodinamika bergantung-waktu dipelajari dalam termodinamika tak-setimbang.
Karena termodinamika tidak berhubungan dengan konsep waktu, telah diusulkan bahwa termodinamika setimbang seharusnya dinamakan termostatik.
Hukum termodinamika kebenarannya sangat umum, dan hukum-hukum ini tidak bergantung kepada rincian dari interaksi atau sistem yang diteliti. Ini berarti mereka dapat diterapkan ke sistem di mana seseorang tidak tahu apa pun kecual perimbangan transfer energi dan wujud di antara mereka dan lingkungan. Contohnya termasuk perkiraan Einstein tentang emisi spontan dalam abad ke-20 dan riset sekarang ini tentang termodinamika benda hitam.
Daftar isi[sembunyikan] |
[sunting] Konsep dasar dalam termodinamika
Pengabstrakan dasar atas termodinamika adalah pembagian dunia menjadi sistem dibatasi oleh kenyataan atau ideal dari batasan. Sistem yang tidak termasuk dalam pertimbangan digolongkan sebagai lingkungan. Dan pembagian sistem menjadi subsistem masih mungkin terjadi, atau membentuk beberapa sistem menjadi sistem yang lebih besar. Biasanya sistem dapat diberikan keadaan yang dirinci dengan jelas yang dapat diuraikan menjadi beberapa parameter.
[sunting] Sistem termodinamika
Sistem termodinamika adalah bagian dari jagat raya yang diperhitungkan. Sebuah batasan yang nyata atau imajinasi memisahkan sistem dengan jagat raya, yang disebut lingkungan. Klasifikasi sistem termodinamika berdasarkan pada sifat batas sistem-lingkungan dan perpindahan materi, kalor dan entropi antara sistem dan lingkungan.
Ada tiga jenis sistem berdasarkan jenis pertukaran yang terjadi antara sistem dan lingkungan:
- sistem terisolasi: tak terjadi pertukaran panas, benda atau kerja dengan lingkungan. Contoh dari sistem terisolasi adalah wadah terisolasi, seperti tabung gas terisolasi.
- sistem tertutup: terjadi pertukaran energi (panas dan kerja) tetapi tidak terjadi pertukaran benda dengan lingkungan. Rumah hijau adalah contoh dari sistem tertutup di mana terjadi pertukaran panas tetapi tidak terjadi pertukaran kerja dengan lingkungan. Apakah suatu sistem terjadi pertukaran panas, kerja atau keduanya biasanya dipertimbangkan sebagai sifat pembatasnya:
- pembatas adiabatik: tidak memperbolehkan pertukaran panas.
- pembatas rigid: tidak memperbolehkan pertukaran kerja.
- sistem terbuka: terjadi pertukaran energi (panas dan kerja) dan benda dengan lingkungannya. Sebuah pembatas memperbolehkan pertukaran benda disebut permeabel. Samudra merupakan contoh dari sistem terbuka.
Dalam kenyataan, sebuah sistem tidak dapat terisolasi sepenuhnya dari lingkungan, karena pasti ada terjadi sedikit pencampuran, meskipun hanya penerimaan sedikit penarikan gravitasi. Dalam analisis sistem terisolasi, energi yang masuk ke sistem sama dengan energi yang keluar dari sistem.
[sunting] Keadaan termodinamika
Ketika sistem dalam keadaan seimbang dalam kondisi yang ditentukan, ini disebut dalam keadaan pasti (atau keadaan sistem).
Untuk keadaan termodinamika tertentu, banyak sifat dari sistem dispesifikasikan. Properti yang tidak tergantung dengan jalur di mana sistem itu membentuk keadaan tersebut, disebut fungsi keadaan dari sistem. Bagian selanjutnya dalam seksi ini hanya mempertimbangkan properti, yang merupakan fungsi keadaan.
Jumlah properti minimal yang harus dispesifikasikan untuk menjelaskan keadaan dari sistem tertentu ditentukan oleh Hukum fase Gibbs. Biasanya seseorang berhadapan dengan properti sistem yang lebih besar, dari jumlah minimal tersebut.
Pengembangan hubungan antara properti dari keadaan yang berlainan dimungkinkan. Persamaan keadaan adalah contoh dari hubungan tersebut.
[sunting] Hukum-hukum Dasar Termodinamika
Terdapat empat Hukum Dasar yang berlaku di dalam sistem termodinamika, yaitu:
- Hukum Awal (Zeroth Law) Termodinamika
-
- Hukum ini menyatakan bahwa dua sistem dalam keadaan setimbang dengan sistem ketiga, maka ketiganya dalam saling setimbang satu dengan lainnya.
- Hukum Pertama Termodinamika
-
- Hukum ini terkait dengan kekekalan energi. Hukum ini menyatakan perubahan energi dalam dari suatu sistem termodinamika tertutup sama dengan total dari jumlah energi kalor yang disuplai ke dalam sistem dan kerja yang dilakukan terhadap sistem.
- Hukum kedua Termodinamika
-
- Hukum kedua termodinamika terkait dengan entropi. Hukum ini menyatakan bahwa total entropi dari suatu sistem termodinamika terisolasi cenderung untuk meningkat seiring dengan meningkatnya waktu, mendekati nilai maksimumnya.
- Hukum ketiga Termodinamika
-
- Hukum ketiga termodinamika terkait dengan temperatur nol absolut. Hukum ini menyatakan bahwa pada saat suatu sistem mencapai temperatur nol absolut, semua proses akan berhenti dan entropi sistem akan mendekati nilai minimum. Hukum ini juga menyatakan bahwa entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol.

Tidak ada komentar:
Posting Komentar